1. 습식도금기술과 관련된 기술을 정리한 노트로, 책을 보듯 그대로 읽으면서 링크를 클릭하면 됩니다.
2. 노트의 자료와 데이타는 실험과 연구 목적으로 이용하여 주십시요. 자료에 대한 어떠한 보증도 없습니다.
3. 잘못된 정보 또는 수정 항목을 알려주시면 POINT를 드립니다.
마크 표기 안내
목차...
수정 분해전압 (分解電壓)
^ decomposition voltage
전해조전압(조전압) 이라고도 하며, 두 전극간의 전압차를 말한다.
물 (도금액 등..) 을 예로 전기분해하기 위하여 용액 내부에 (+,-) 전극을 설치하고, 전극간의 전압을 걸면 전류가 흐르게 된다. 서서히 전압을 올리면 약 2∼3 볼트 (V) 까지 일정한 비례로 전류가 증가하나, 어느 전압에서 갑자기 전류의 흐름이 증가하게 된다.
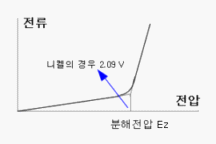
이처럼 갑자기 전류의 흐름이 높아지는 지점의 전압을 분해전압 이라고 한다. 즉, 전류는 2∼3 볼트 (V) 의 분해전압까지는 천천히 상승하고, 그 이상에서는 급격히 증가 하게 되며, 이 전압 이상이 되어야 비로소 용액의 산화 환원 반응을 수반한 금속의 석출이 시작된다.
<>분해 전압보다 낮게 되면 금속의 석출은 이루어지지 않고 가스만 발생된다. 분해전압은 금속이나 금속염의 수용액의 종류에 따라 다르다.
분해전압 Ez 는 Er + Eohm + Eir
Er : 이론 최소전압 = 양극 음극 단자전위차
Eohm : 전해액의 전기저항을 이겨서 전류를 흘려야할 전압
Eir : 저항 이외의 과전압등에 필요한 전압
금속염의 분해전압
| 전해액 | 조성 | 분해전압(V) |
|
황산아연 황산니켈 황산카드뮴 황산코발트 황산구리 황산은 가성소다 암모니아수 황산 |
ZnSO4 NiSO4 CdSO4 CoSO4 CuSO4 AgNO3 NaOH NH4OH H2SO4 |
2.35 2.09 2.03 1.92 1.49 0.70 1.69 1.74 1.67 |
수정 참고




