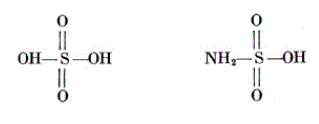1. 습식도금기술과 관련된 기술을 정리한 노트로, 책을 보듯 그대로 읽으면서 링크를 클릭하면 됩니다.
2. 노트의 자료와 데이타는 실험과 연구 목적으로 이용하여 주십시요. 자료에 대한 어떠한 보증도 없습니다.
3. 잘못된 정보 또는 수정 항목을 알려주시면 POINT를 드립니다.
마크 표기 안내
목차...
수정 설파민산 ㆍ Sulfamic Acid
^ Amidosulfuric Acid
Sulfamic acid 또는 아미드황산
H3N+SO3- 로 표시되는 무색의 고체
물에 용해되는 강산이다.
- 도금에서는 고속 니켈도금인 설파민산 니켈도금의 주염인 설파민산 니켈 등의 제조에 이용된다
- 디아조 염료의 염색에서 잔류 아초산염을 분해, 전기도금 등에 이용한다.
- 황산에 하이드록실기가 아미노기에 치환된 것으로 요소와 발연황산으로 반응하여 제조한다.
CO(NH2)2 + H2S2O7 → 2(NH2)HSO3 + CO2
- 설파민산은 중성형 H2NSO2(OH) 가 아닌 호변이성 쌍성이온의 하나로 H3N+SO3- 의 성질을 가지고 있다. 중성자 산란의 실험에 따르면 4 종류의 이성체 중성형 H2NSO2(OH), HN=SO(OH)2, 쌍성이온형 H3N+SO3-, H2N+=SO(OH)O- 가운데 H3N+SO3-의 구조가 중요한 것으로 확인되었다.
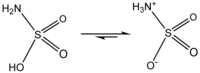
설파민산은 강산형으로 고체는 흡수성을 나타내지 않아 높은 품질의 제품을 만들수 있어 산염기 적정의 표준 물질로도 이용된다. 암모니아수 중에서는 2 단계의 탈 프로톤화의 영향을 받아 디아니온 NHSO32- 로 된다. 설파민산의 고체는 205 ℃ 에 용해되며, 온도를 더 높이면 분해하여 삼산화유황, 이산화유황, 질소분자로 바뀐다. 아미노기가 전자구인기와 결합하는 점은 요소와 공통점이 있다. 예로 수용액을 가열하면 암모늄 이온을 생성한다.
- 아질산과 반응하여 질소 가스를 발생한다.
HNO2 + (NH2)HSO3 → H2SO4 + N2 +H2O
- 수산화나트륨 용액의 정확한 농도를 구하는 표정용으로 이용한다.
(NH2)HSO3 + NaOH→ (NH2)NaSO3 + H2O
- 환원제로서는 질산과 반응하여 아산화질소를 발생한다.
HNO3 + (NH2)HSO3→ H2SO4 + N2O + H2O
- 냉수중에는 서서히, 80 ℃ 이상에서는 빠르게 가수분해하여 유황수소암모늄으로 된다.
(NH2)HSO3 + H2O →(80 ℃ 이상) NH4HSO4
Sulfuric Acid H2SO4 Sulfamic Acid HSO3NH2
수정 참고