수정 전기분해 과정
^ Electrolysis Process
농도가 0.1 ㏖/ℓ 인 묽은 황산을 예로하여 전기분해의 실제 모습을 살펴보면, 두개의 백금전극을 묽은 황산용액에 넣고 전압을 올리면 1.5 V 부터 전류가 흐르기 시작한다.
수정 전압이 낮을 때
양쪽 전극에 1 V 의 전원을 걸었다고 가정하자. 0.1 M 묽은 황산의 해리도는 0.55, 그중 약 0.11 M 은 H+ 이고 0.09 M 은 HSO4-, 0.01 M 는 SO4(2-) 로 존재한다. 미량의 SO4(2-) 는 무시할 수 있다.
(+) 전극 부근에는 HSO4- 가, (-) 전극 부근에는 H+ 가 모이게 되지만, 같은 부호의 전하는 강하게 반발하기 때문에 아주 조금만 모이고 곧 움직임이 멈춘다.
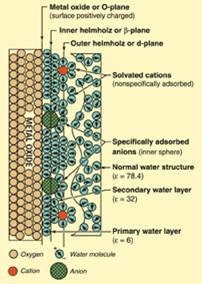
이때 입자 전극 자체의 전하를 전혀 느끼지 못하게 되나 그 두께가 충분히 얇으면 분자도 이온도 전극 옆까지 와 전자를 교환 할 수 있다. (→전기적 이중층)
수정 전압이 충분히 클때
0.1 M 의 묽은 황산에는 H2O, H+, HSO4-, SO4(2-) 등의 물질이 존재하는데, 이중에 H+ 가 가장 환원이 되게 쉽고, H2O 가 가장 산화가 되기 쉽다. 충분히 큰 전압이 걸리면
Cathode 4H+ + 4e- → 2H2
Anode 2H2O → 2H+ + O2 + 4e-
cathode 부근의 용액은 H+ 의 소비로 줄어드는 정전하를 보충하기 위해 용액 본체로부터 H+가 헤엄쳐 나온다, 한편 anode 는 늘어나는 정전하 (H+) 를 중화시키기 위해 HSO4-, SO4(2-) 가 오게 된다.
∴ 전기분해가 일어나기 때문에 전류가 흐른다. (역은 성립X)
수정 참고




