수정 무전해 구리도금에서의 반응
^ Electroless Copper Solution
무전해 구리도금은 구리 기판상에 포르말린의 산화반응 (국부 아노드반응) 과 구리이온의 환원반응 (국부 캐소드반응) 이 진행하여 국부전지 반응을 만든다.
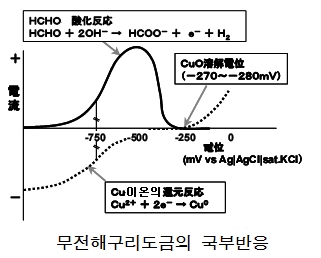
이때 도금 전위는 국부 아노드 반응과 국부 캐소드 반응이 바란스되는 전위는 참고 도금액일 경우 약 -750 mV 정도이다. 다른 면으로 약 -280 mV 보다도 아노드측의 전위로는, 구리의 용해가 관찰되고
2Cu + O2 → 2CuO …(1)
CuO + EDTA4 - + H2O → CuEDTA2- + 2OH- …(2)
도금액 중에 용해된 구리표면을 관찰하면 광택이 있는 구리색으로 되며, 도금액 중의 구리반응은 (1) 의 반응이 진행되는 것으로 추정된다. 도금액중에는 공기를 투입하여 도금하는 것이 일반적이므로, 액중의 가스의 산소분압을 높혀, (1) 식의 반응속도를 증대하여 도금액에 있어서도 구리용해가 가능하다고 추정된다.
수정 도금액 내의 여러반응
HCHO + 3OH- → HCOO- +2H2O +2e-
2HCHO + 4OH - → 2HCOO - + 2H2O + H2 + 2e- ↑ (촉매 PdㆍCuㆍAg 등)
2H + Cu++ → Cu + H2
Cu2+ + 2e- → CuO
이때의 E0 = + 0.34 V
㏗ 가 0 일때
HCHOOH + 2H+ + 2e → HCHO + H2O
이때의 E0 = + 0.056 V
㏗ 가 14 일때
HCOO- + 2H2 + 2e → HCHO + 3OH-
이때의 E0 = + 1.070 V
따라서 반응은 ㏗ 12 이상이 요구되고, 이때 구리 이온은 용해되지 않으므로 착체염이 필요하다.
2Cu + HCHO + 5 OH → Cu2O + HCOO + 3H2O 의 Fehling (페링 반응)
Cu2O + H2O → Cu + Cu2+ + 2OH disproportionation (불균화 반응)
2CHO + OH → CH3OH + HCOO- cannizzarro (카니차로 반응)
0.04 ㏖/l CuSO4·5H2O
0.1 ㏖/l EDTA
0.03 ㏖/l HCHO
㏗ 12.5 (NaOH 조정)
첨가제 적량
- 액온도 74 ℃
수정 참고




